(Zunächst ist das hier natürlich nur auf die Schnelle runtergeschrieben. Ich werde das dann noch fortlaufend auch um Bilder ergänzen.)
1. Proteine
2. Wo anknüpfen für die Wirkstofffindung?
3. Falten
4. Docking
Quellen
1. Proteine
Proteine sind lange Ketten aus mindestens 50 - 100 Aminosäuren.
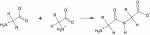
Sie können grundsätzlich in verschiedene Gruppen eingeteilt werden. Das sind:
- Enzyme
- Transportproteine
- Toxine
- Motorproteine
- Regulatoren
- Hormone
- Reserveproteine
- Schutzproteine
- Strukturproteine
- Neurotransmitter
Will man eine Krankheit verstehen und/oder bekämpfen stößt man häufig auf beteiligte Proteine. Ein sehr bekanntes Beispiel: Insulin - ein Peptidhormon.
2. Wo anknüpfen für die Wirkstofffindung?
Habe ich ein beteiligtes Protein ausgemacht, gibt es verschiedene Möglichkeiten:
Es gibt Proteine, die die Wirkung direkt auslösen. Bungarotoxin, das Gift der Kobra, oder das menschliche Wachstumshormon zum Beispiel. Bei solchen Proteinen versucht man ähnliche Stoffe zu finden beziehungsweise zu synthetisieren, die dann entweder eben genauso wirken oder eben gerade nicht.
Zum anderen gibt es Proteine, die erst etwa durch ein Hormon angeregt werden müssen. Troponin C zum Beispiel, das eine Rolle bei der Muskelkontraktion spielt und durch Calcium angeregt wird. Bei solchen Proteinen gibt es eine Bindungstasche, in der der Botenstoff gebunden werden kann und man versucht Stoffe zu finden, die auch eine Wirkung auslösen oder die Bindungstasche blockieren können.
Drittens gibt es
Krankheitsbilder, die dadurch entstehen, dass sich die Proteine bei ihrer Faltung in einem lokalen energetischen Minimum festsetzen. Das heißt, es wird eine Faltung erreicht, die zwar nicht so stabil ist, wie die "richtige" Faltung, aber stabil genug, dass die Faltung nicht mehr erfolgreich zum Abschluss gebracht wird. Solche falsch gefalteten Proteine können toxische Wirkung haben und werden normalerweise sofort abgebaut. Problematisch wird es, wenn sich die falsch gefalteten Proteine ablagern - das ist zum Beispiel bei Alzheimer der Fall - oder wenn so viele Proteine falsch gefaltet werden, dass nicht mehr genug richtig gefaltete Proteine existieren - ein Beispiel dafür ist Phenylketonurie.
Bei solchen Krankheitsbildern wollen wir natürlich wissen, wie die falsch gefalteten Proteine im Vergleich aussehen. Mögliche Medikamente sollen die falsch gefalteten Proteine vernichten ohne den anderen zu schaden oder noch besser verhindern, dass Proteine in das lokale Energieminimum reingefaltet werden.
3. Falten
Entgegen dem, was so im Chemieunterricht in der Schule passiert, gibt die Strukturformel eines Moleküls eben nicht immer automatische auch die dreidimensionale Struktur wieder.
Viele Bindungen sind nicht rigide und können zum Beispiel gedreht werden, so dass schon von relativ kleinen Molekülen oft mehrere räumliche Versionen existieren. Nun besteht aber ein Protein aus mindestens 50 bis 100 Aminosäuren und jede Aminosäure aus mindestens 9 Atomen. Ganz schön viele Bindungen also. Viele Möglichkeiten für die dreidimensionale Struktur.
Neben den gewöhnlichen kovalenten Bindungen zwischen Atomen existieren noch einige andere Kräfte, die zu Bindungen oder Abstoßungen führen. In der Summe aller Kräfte lässt sich dann für jede Konfiguration des Moleküls errechnen, wie viel Energie gebraucht wird, um diese einzunehmen.
Das einfachste Computer-gestütze Falten ist nun ein Brute-force-Ansatz: Es werden einfach alle räumlichen Anordnungen durchprobiert, um diejenige zu finden, die mit der geringsten Kraft gebildet werden kann. Man nimmt an, dass diese oft der richtigen Struktur entspricht.
Das folgende Video zeigt ganz gut (so sieht es auf den Bildschirmen in unserer Arbeitsgruppe auch oft aus), wie sprunghaft optimiertere Algorithmen dann tatsächlich zu Werke gehen:
https://www.youtube.com/watch?v=meNEUTn9Atg
4. Docking
Docking versucht daraufhin potentielle Liganden in die Bindungstasche eines Proteins einzupassen. Je besser die Struktur des Proteins bekannt ist, desto besser kann dies natürlich auch gelingen.
So kommt hier mein vorläufiges populistisches Todschlagargument:
Strukturaufklärung von Proteinen ---> genauere Selektion möglicher Wirkstoffe ---> weniger In-Vivo-Versuche
Quellen:
Wirkstoffdesign | Klebe, G. | 2. Auflage 2009 | Springer
Stoffwechsel- und Formelsammlung Biochemie | 1. Auflage 2005 | Elsevier
Biochemie | Berg, J. Tymoczko, J. Stryer, L. | 7. Auflage 2013 | Springer
Anmerkungen, Anregungen, Kritik und Ergänzungen bitte per PM damits übersichtlich bleibt!

